| |
| Med Sci (Paris). 2007 January; 23(1): 75–80. Published online 2007 January 15. doi: 10.1051/medsci/200723175.La signalisation FSH a-t-elle un sexe ? Charlotte Lécureuil, Elodie Kara, Florian Guillou, Danielle Monniaux, and Pascale Crépieux* Physiologie de la Reproduction et des Comportements, UMR 6175 INRA-CNRS-Université de Tours-Haras Nationaux-IFR 135, 37380 Nouzilly,France |
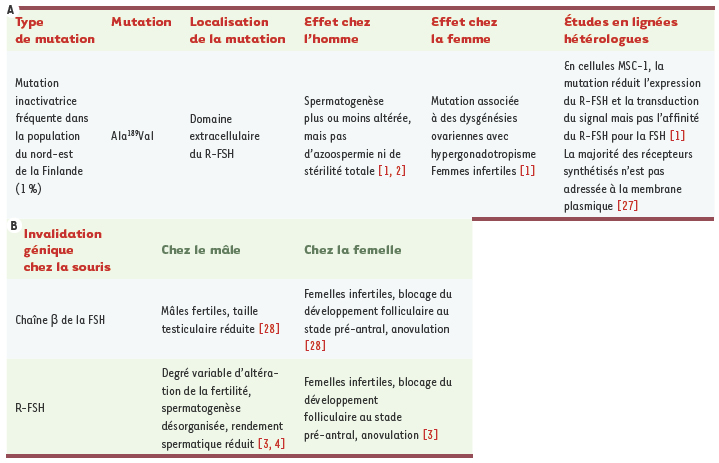
L’hormone folliculo-stimulante (FSH) est une hormone-clé de la reproduction. Sécrétée par l’hypophyse, elle régule une centaine de gènes dont l’expression au niveau des gonades conduit in fine à l’accomplissement de la gamétogenèse, dans les deux sexes. Pour y parvenir, la FSH agit via un récepteur à sept domaines transmembranaires, le R-FSH, sélectivement exprimé par les cellules somatiques, c’est-à-dire les cellules de Sertoli chez le mâle et les cellules de la granulosa chez la femelle, qui constituent le support physique et métabolique des cellules germinales en maturation dans les gonades. L’analyse phénotypique d’hommes et de femmes porteurs de mutations du R-FSH révèle que la FSH n’a pas la même importance dans la fertilité selon le sexe (Tableau IA). Ainsi, une mutation inactivatrice du R-FSH provoque une infertilité totale chez la femme [
1] alors que la fertilité des hommes porteurs de la même mutation présente toutes les variantes allant de normale à sévèrement altérée [
2]. De la même façon, l’invalidation du gène codant le R-FSH chez la souris mime le phénotype des mutations retrouvées naturellement dans l’espèce humaine (Tableau IB). Les femelles sont complètement infertiles, elles n’ont pas d’ovulation car le développement de leurs follicules est bloqué à un stade précoce, avant la formation de l’antrum (Figure 1B). En revanche, les mâles restent fertiles malgré une spermatogenèse désorganisée et une diminution de la sécrétion d’androgènes [
3,
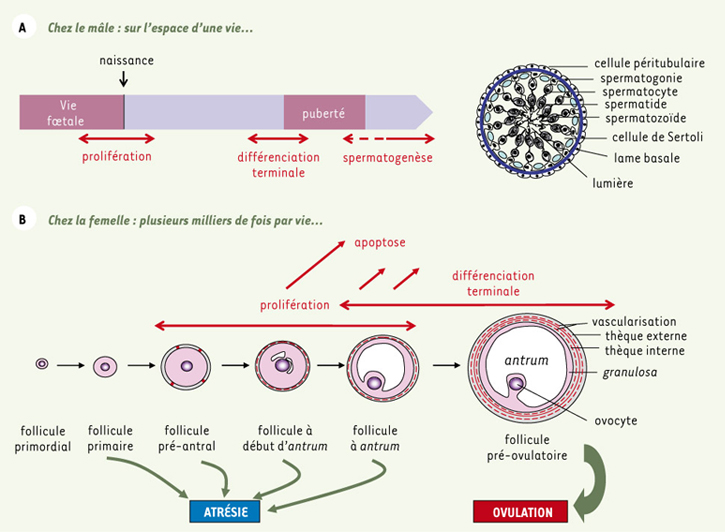
4]. Ces différences phénotypiques s’expliquent-elles par une fonction biologique distincte de la FSH chez le mâle et chez la femelle ? La fonction principale de la FSH est de réguler les phases de prolifération et de différenciation des cellules de Sertoli et de la granulosa. Cependant, ces phases de prolifération/différenciation ont lieu à des moments distincts au cours du développement. En effet, les cellules de Sertoli prolifèrent durant la vie embryonnaire et périnatale jusqu’au moment de la mise en place de la barrière testiculaire, peu avant la puberté. La population de cellules de Sertoli a alors atteint sa taille définitive pour toute la vie, leur apoptose étant anecdotique (Figure 1A). Puisque chaque cellule de Sertoli ne peut assurer le développement que d’un nombre maximal de cellules germinales, le nombre de cellules de Sertoli présent dans les tubes séminifères à la puberté conditionne directement le rendement de la spermatogenèse. Chez la femelle, c’est pendant la vie fœtale que se constitue la réserve ovarienne de cellules germinales au sein des follicules primordiaux. Dès leur formation, et tout au long de la vie de la femelle jusqu’à épuisement de cette réserve, des follicules primordiaux peuvent entrer en croissance et se développer jusqu’à l’ovulation ou dégénérer par atrésie pour plus de 99 % d’entre eux (Figure 1B). Au sein des follicules, les cellules de la granulosa prolifèrent activement, puis se différencient en cellules stéroïdogènes au cours du développement terminal des follicules ou dégénèrent par apoptose dans les follicules atrétiques. La FSH est le chef d’orchestre de ce développement folliculaire dont elle contrôle à la fois la prolifération et la différenciation. De plus, elle protège des follicules de l’atrésie en inhibant l’apoptose et c’est principalement par ce biais que l’action de la FSH dans la granulosa se démarque de celle qu’elle assume dans la cellule de Sertoli.  | Figure 1.
A. Le développement sertolien, de la vie fœtale au stade adulte. Sur la droite est représentée une coupe transversale de tube séminifère. On voit les cellules germinales aux différents stades de leur maturation, enchâssées dans la hauteur des cellules de Sertoli. B. Les principales étapes du développement folliculaire ovarien incluant le développement des cellules de la granulosa. |
 | Tableau I.
A. Effets d’une mutation naturelle inactivatrice du R-FSH (récepteur FSH) chez l’homme et chez la femme, ainsi qu’en système hétérologue. La mutation Ala 189Val a été identifiée dans la population finlandaise, mais n’est pas retrouvée dans d’autres populations (notamment en Suisse, au Danemark, et à Singapour [
26]). L’analyse de cette mutation en cellules de Sertoli immortalisées montre que le R-FSH Ala 189Val est mal adressé à la membrane plasmique. B. Phénotypes observés chez la souris dont le gène de la sous-unité β de la FSH ou le gène du R-FSH a été invalidé.
|
L’implication de la FSH dans le développement des cellules de Sertoli et de la granulosa pousse à s’interroger sur la nature des mécanismes de signalisation induits par l’hormone chez le mâle et chez la femelle. L’objet de cet article est de répertorier certains de ces mécanismes ainsi que les gènes-cibles dont ils régulent l’expression afin d’en dégager les conséquences au niveau de la physiologie de la reproduction de chaque sexe. |
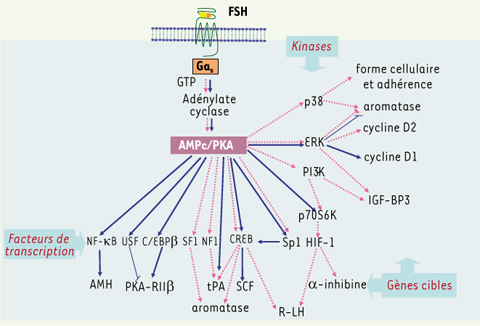
La PKA, carrefour obligé de toute la signalisation FSH ? Historiquement, la voie AMPc-PKA (protéine kinase AMPc-dépendante) a été la première voie de signalisation impliquée dans la réponse à la FSH. Il semble bien que cette voie soit aussi requise pour l’activation de la plupart des mécanismes de signalisation induits par la FSH. Aussi bien dans la cellule de Sertoli que dans celle de la granulosa, l’activation de l’adénylate cyclase par la FSH augmente la concentration intracellulaire en AMPc qui stimule à son tour la PKA. La PKA est responsable de la phosphorylation/activation de nombreux facteurs de transcription dont ceux de la famille CREB/CREM [
5]. Une fois phosphorylé, CREB stimule la transcription de nombreux gènes marqueurs de la fonction des cellules de Sertoli et de la granulosa
(Figure 2) ou encore des gènes de prolifération comme les gènes des cyclines D. Chez le mâle, l’importance de la phosphorylation de CREB pour la fertilité a été montrée en surexprimant in vivo, dans les cellules de Sertoli, un mutant de CREB non phosphorylable. Il en résulte une spermatogenèse perturbée avec une apoptose des spermatocytes, ce qui suggère que CREB est nécessaire à la production d’un facteur dérivé des cellules de Sertoli utile à la survie des cellules germinales [
6]. De même, chez la femelle, l’activation de CREB par la PKA joue un rôle majeur dans la différenciation des cellules de la granulosa induisant l’expression de l’aromatase et du récepteur LH (luteinizing hormone) dans les follicules pré-ovulatoires. D’autres facteurs de transcription tels que Sp1, NF-κB, SF-1, USF, NF-1, HIF-1α et C/EBPβ sont également activés par un taux élevé d’AMPc intracellulaire [
7].  | Figure 2.
Mécanismes de signalisation AMPc ou PKA-dépendants dans les cellules de Sertoli (trait plein) et de la granulosa (trait pointillé) stimulées par la FSH. À droite de la figure sont indiquées les kinases concernées, en bas, les facteurs de transcriptions et les gènes cibles dont ils régulent l’expression. On constate qu’il y a relativement peu de flèches en commun, car les différents gènes et mécanismes de signalisation n’ont pas toujours été équitablement étudiés dans chaque sexe, ce qui complique la comparaison. AMH : anti-müllerian hormone ; USF : upstream stimulating factor ; C/EBPβ : CCAAT-box/enhancer-binding protein β ; SF1 : steroidogenic factor 1 ; CREB : cyclic AMP response (CRE)-binding protein ; SCF : stem cell factor ; HIF-1 : hypoxia-inductible factor 1. |
En réponse à la FSH, la PKA stimule les MAP-kinases de type ERK dont l’activation est nécessaire à l’action mitogène de l’hormone sur les cellules de Sertoli immatures et sur les cellules de la granulosa. Dans les cellules de Sertoli immatures, les ERK stimulent l’expression de la cycline D1 et l’activité du régulateur transcriptionnel E2F1. A l’inverse, dans les cellules de Sertoli d’animal pré-pubère qui sont en cours de différenciation terminale, la FSH inhibe les ERK [
8], mais aucune donnée, à ce jour, n’indique que leur inactivation est causale dans la différenciation sertolienne. Chez la femelle, en réponse à la FSH, les ERK stimulent l’expression de la cycline D2 dans les cellules de la granulosa immatures [
9], participant ainsi à la régulation de leur prolifération. Les ERK sont également activées par la FSH dans les cellules de la granulosa en cours de différenciation ; la synthèse d’œstradiol, qui caractérise les cellules de la granulosa différenciées, serait régulée par un équilibre entre les MAPK ERK et p38, toutes deux activées par la PKA sous l’action de la FSH. Chez les Rongeurs, les cellules de la granulosa stimulées in vitro par la FSH s’arrondissent et s’agrègent entre elles. La p38 MAPK semble être impliquée dans ce processus puisque son inhibition pharmacologique empêche cette modification de forme induite par la FSH. L’activation PKA-dépendante de cette voie par la FSH permet la phosphorylation de la protéine HSP-27 qui participe à la réorganisation des filaments d’actine [
10]. L’effet de la FSH sur la forme des cellules de Sertoli en culture et sur l’activation de la p38 MAPK n’a pas été exploré. Cependant, l’adhérence des cellules de Sertoli au substratum affecte l’activation des ERK par la FSH qui n’est possible que lorsque les cellules de Sertoli sont cultivées sur un support. Cette perte d’activation des ERK en réponse à la FSH lorsque les cellules sont maintenues en suspension est dépendante de l’AMPc [
11]. La mise en évidence récente de l’activation de la p70 S6 kinase par la FSH, via l’activation de la PKA, a soulevé la possibilité que l’hormone puisse réguler ses gènes cibles au niveau de leur traduction. En effet, la p70 S6 kinase est impliquée dans la phosphorylation de la protéine ribosomale S6 ou dans celle du facteur eIF-4B (eukaryotic initiation factor-4B), l’un des constituants du complexe d’initiation de la traduction. Elle est activée par la FSH d’une manière AMPc-dépendante aussi bien au cours de la différenciation folliculaire que sertolienne, mais, curieusement, son mode d’activation est très différent : la FSH induit la phosphorylation de la Thr 389 dans la granulosa [
12], mais pas dans la cellule de Sertoli dans laquelle la FSH active l’enzyme en déphosphorylant son site Thr421/Ser424 [
13]. En d’autres termes, contrairement à ce qui est observé dans la granulosa, le mode d’activation de la p70 S6 kinase par la FSH dans la cellule de Sertoli est très différent du modèle classique d’activation de cette enzyme par les récepteurs à activité tyrosine kinase comme celui de l’insuline par exemple. |
Une régulation fine du niveau d’AMPc par la FSH chez le mâle et la femelle La concentration d’AMPc dans la cellule est dépendante à la fois de son taux de synthèse par les adénylate-cyclases et de son taux de dégradation par les phosphodiestérases (PDE). Dans les cellules de Sertoli et de la granulosa, la FSH régule la synthèse de certaines PDE de manière dépendante de l’AMPc. Cette régulation est importante pour la physiologie ovarienne puisque, chez les souris PDE4D−/−
, l’augmentation du niveau basal d’AMPc est responsable d’une diminution de sensibilité des cellules de la granulosa aux gonadotropines et d’une perturbation de l’ovulation [
14]. Un autre moyen de réguler finement la concentration intracellulaire en AMPc est la désensibilisation du R-FSH qui débute dans les minutes qui suivent l’exposition des cellules à l’hormone et résulte du découplage du récepteur activé de ses effecteurs intracellulaires. Dans la cellule de Sertoli, comme dans celle de la granulosa, la désensibilisation du R-FSH se traduit par une diminution de la production d’AMPc. La PKCβ pourrait être impliquée dans la désensibilisation du R-FSH dans des cellules de granulosa en lignée [
15]. Dans les cellules de Sertoli, l’exposition à la FSH s’accompagne du recrutement quasi-immédiat à la membrane plasmique de kinases spécifiques des récepteurs couplés aux protéines G, les GRK (G-protein coupled receptor kinases). Leur surexpression conduit à une diminution du signal AMPc, ce qui illustre bien leur rôle dans la désensibilisation du R-FSH [
16]. La GRK la plus largement exprimée dans la cellule de Sertoli est la GRK2 (G protein-coupled receptor kinase 2). Or, des études en lignées hétérologues ont montré que le R-FSH est phosphorylé par la protéine kinase C et par la GRK2 [
17]. En présence prolongée d’hormone, il existe un second mécanisme de désensibilisation à la FSH qui passe par la perte d’expression de l’ARNm de son récepteur (down-régulation). Cette down-regulation dépend d’un répresseur de l’activité transcriptionnelle de CREM dépendant de l’AMPc, ICER [
18]. Pour l’instant, on ignore toujours les bases moléculaires de la désensibilisation du R-FSH et de la down-regulation de la réponse FSH dans la cellule de la granulosa, bien que les protéines impliquées dans ces mécanismes y soient aussi exprimées. |
Action concertée de la FSH et de l’IGF pour le contrôle de la prolifération et de la différenciation des cellules de Sertoli et de la granulosa
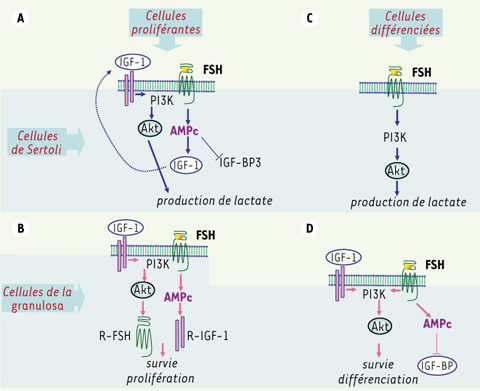
La FSH stimule le métabolisme des hydrates de carbone qui est particulier aux cellules de Sertoli. En effet, ces cellules convertissent majoritairement leur glucose en lactate que les cellules germinales post-méiotiques préfèrent au glucose comme source principale d’énergie. C’est d’ailleurs là que se situe l’une des fonctions nourricières principales des cellules de Sertoli vis-à-vis des cellules germinales. Cette fonction est stimulée par la FSH qui accélère le transport du glucose à l’initiation du processus et augmente l’activité de la lactate déshydrogénase, enzyme qui convertit le pyruvate en lactate en fin de chaîne métabolique. Chez le jeune, la FSH stimule la production de lactate en agissant de conserve avec un régulateur bien connu du métabolisme glucidique, l’IGF1 (insulin-like growth factor 1) [
19]. Or, dans la suite du développement post-natal, la FSH se substitue progressivement à l’action de l’IGF1 [
20]. La voie PI-3 kinase est impliquée dans la production de lactate par les cellules de Sertoli, indirectement par l’IGF-1 chez le jeune, et de façon autonome par la FSH à partir de la puberté (Figure 3A).
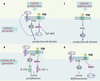 | Figure 3.
Activation de la voie PI-3 kinase/Akt par la FSH. Activation indirecte par stimulation autocrine de la production d’IGF-1 (insulin-like growth factor 1) dans les cellules de Sertoli de raton (A), et par stimulation de la synthèse de récepteurs de l’IGF-1 dans les cellules de granulosa en prolifération (B). La FSH stimule cette voie de façon directe dans les cellules de Sertoli du mâle pré-pubère (C) et dans les cellules de granulosa en différenciation terminale (D). Les protéines de liaison des IGF (IGF-BP) modulent la bioactivité de l’IGF-1. |
De la même façon, les effets de la FSH et l’IGF1, qui contrôlent tous deux la prolifération, la différenciation et la survie des cellules de la granulosa, sont bien souvent intriqués au cours du développement folliculaire (Figure 3B). D’ailleurs, chez des souris, dans lesquelles le gène codant l’IGF1 ou celui codant la sous-unité β de la FSH a été inactivé, le développement folliculaire est comparable puisqu’il s’arrête dans les deux cas au stade de follicule pré-antral. Chez les rongeurs, l’IGF1 stimule l’expression du gène du R-FSH, permettant ainsi aux cellules de la granulosa d’augmenter leur sensibilité à la FSH et de se différencier en cellules stéroïdogènes [
21]. L’IGF1 amplifie l’action de la FSH sur l’induction de l’aromatase et joue un rôle de médiateur dans l’effet anti-apoptotique de FSH sur les cellules de la granulosa. En retour, la FSH augmente l’expression du récepteur de l’IGF1 chez les rongeurs. De plus, chez toutes les espèces de mammifères, la FSH inhibe la synthèse des protéines de liaison des IGF et stimule leur protéolyse, augmentant ainsi la biodisponibilité de l’IGF1 pour les cellules de la granulosa au cours du développement folliculaire terminal précédant l’ovulation [
22]. De façon intéressante, ces deux facteurs activent des mécanismes de signalisation communs, touchant principalement la voie PI-3 kinase/Akt impliquée dans la survie et la prolifération des cellules de la granulosa et induisent, par cette voie, la phosphorylation du facteur de transcription Foxo-1, permettant sa redistribution du noyau vers le cytoplasme [
23]. Pour permettre la différenciation du follicule pré-ovulatoire, la FSH lève l’inhibition transcriptionnelle exercée par Foxo-1 sur les gènes P450 aromatase, épiréguline ou inhibine α, vraisemblablement en activant de façon autonome Sgk (serum/glucocorticoid-regulated kinase) et PKB [
24]. En système cellulaire hétérologue, le R-FSH peut d’ailleurs interagir directement avec un adaptateur, APPL1, connu pour s’associer à PKB [
25]. |
La FSH régule des mécanismes de signalisation analogues dans les deux sexes ; c’est pourquoi la nature des voies de signalisation mises en jeu dans la réponse FSH ne semble pas rendre compte des différences de phénotype observées lorsque la transmission de cette réponse au niveau du récepteur est altérée par mutation ou invalidation expérimentale. Toutefois, des divergences majeures apparaissent dans le mode d’action de la FSH chez le mâle et chez la femelle : (1) dans le testicule, l’action de la FSH porte sur des étapes de développement bien distinctes puisque la prolifération des cellules de Sertoli n’a lieu qu’avant la puberté ; en revanche, tout au long de la vie de la femelle, ces étapes se succèdent de façon continue et se chevauchent au sein de chaque follicule ovarien en développement ; (2) la FSH joue un rôle anti-apoptotique crucial dans les cellules de la granulosa, régulant finement l’entrée en atrésie ou la poursuite du développement folliculaire jusqu’à l’ovulation. En conjonction avec l’action de l’IGF-1, l’activation de la voie PI-3 kinase semble essentielle dans la régulation de leur survie. Cette fonction particulière de la FSH pourrait suffire à expliquer le caractère dramatique des mutations de son récepteur chez la femme ou de l’invalidation expérimentale de ce dernier ; (3) les mêmes voies de signalisation peuvent être activées par la FSH pour transmettre un signal comparable, mais selon des modalités distinctes dans chaque sexe, comme c’est le cas pour la voie p70 S6 kinase. Il semble donc que la FSH active des mécanismes de signalisation analogues dans les deux sexes, mais dans des fenêtres temporelles d’activation distinctes au cours desquelles l’action des autres facteurs paracrines des gonades pourrait être déterminante pour la réponse biologique ultime. |
Footnotes |
1. Aittomaki K, Lucena JL, Pakarinen P, et al. Mutation in the follicle-stimulating hormone receptor gene causes hereditary hypergonadotropic ovarian failure. Cell 1995; 82 : 959–68. 2. Tapanainen JS, Aittomaki K, Min J, et al. Men homozygous for an inactivating mutation of the follicle-stimulating hormone (FSH) receptor gene present variable suppression of spermatogenesis and fertility. Nat Genet 1997; 15 : 205–6. 3. Dierich A, Sairam MR, Monaco L, et al. Impairing follicle-stimulating hormone (FSH) signaling in vivo: targeted disruption of the FSH receptor leads to aberrant gametogenesis and hormonal imbalance. Proc Natl Acad Sci USA 1998; 95 : 13612–7. 4. Krishnamurthy H, Danilovich N, Morales CR, et al. Qualitative and quantitative decline in spermatogenesis of the follicle-stimulating hormone receptor knockout (FORKO) mouse. Biol Reprod 2000; 62 : 1146–59. 5. Foulkes NS, Schlotter F, Pevet P, et al. Pituitary hormone FSH directs the CREM functional switch during spermatogenesis. Nature 1993; 362 : 264–7. 6. Scobey M, Bertera S, Somers J, et al. Delivery of a cyclic adenosine 3’,5’-monophosphate response element-binding protein (creb) mutant to seminiferous tubules results in impaired spermatogenesis. Endocrinology 2001; 142 : 948–54. 7. Richards JS. New signaling pathways for hormones and cyclic adenosine 3’,5’-monophosphate action in endocrine cells. Mol Endocrinol 2001; 15 : 209–18. 8. Crépieux P, Marion S, Martinat N, et al. The ERK-dependent signalling is stage-specifically modulated by FSH, during primary Sertoli cell maturation. Oncogene 2001; 20 : 4696–709. 9. Kayampilly PP, Menon KM. Inhibition of extracellular signal-regulated protein kinase-2 phosphorylation by dihydrotestosterone reduces follicle-stimulating hormone-mediated cyclin D2 messenger ribonucleic acid expression in rat granulosa cells. Endocrinology 2004; 145 : 1786–93. 10. Maizels ET, Cottom J, Jones JCR, et al. Follicle-stimulating hormone (FSH) activates the p38 mitogen-activated protein kinase pathway, inducing small heat-shock protein phosphorylation and cell rounding in immature rat ovarian granulosa cells. Endocrinology 1998; 139 : 3353–6. 11. Crépieux P, Martinat N, Marion S, et al. Cellular adhesion of primary Sertoli cells affects responsiveness of the extra-cellular signal-regulated kinases 1,2 to follicle-stimulating hormone but not to epidermal growth factor. Arch Biochem Biophys 2002; 399 : 245–50. 12. Alam H, Maizels ET, Park Y, et al. FSH activation of HIF-1 by the PI3-kinase/AKT/Rheb/mTOR pathway is necessary for induction of select protein markers of follicular differentiation. J Biol Chem 2004; 279 : 19431–40. 13. Lécureuil C, Tesseraud S, Kara E, et al. Follicle-stimulating hormone activates p70 ribosomal protein S6 kinase by protein kinase A-mediated dephosphorylation of Thr 421/Ser 424 in primary Sertoli cells. Mol Endocrinol 2005; 19 : 1812–20. 14. Jin SL, Richard FJ, Kuo WP, et al. Impaired growth and fertility of cAMP-specific phosphodiesterase PDE4D-deficient mice. Proc Natl Acad Sci USA 1999; 96 : 11998–2003. 15. Manna PR, Pakarainen P, Rannikko AS, et al. Mechanisms of desensitization of follicle-stimulating hormone (FSH) action in a murine granulosa cell line stably transfected with the human FSH receptor complementary deoxyribonucleic acid. Mol Cell Endocrinol 1998; 146 : 163–76. 16. Marion S, Robert F, Crépieux P, et al. GRKs and beta-arrestins are relocalized and attenuate cAMP response to FSH in rat primary Sertoli cells. Biol Reprod 2002; 66 : 70–6. 17. Krishnamurthy H, Galet C, Ascoli M. The association of arrestin-3 with the follitropin receptor depends on receptor activation and phosphorylation. Mol Cell Endocrinol 2003; 204 : 127–40. 18. Monaco L, Foulkes NS, Sassone-Corsi P. Pituitary follicle-stimulating hormone (FSH) induces CREM gene expression in Sertoli cells: involvement in long-term desensitization of the FSH receptor. Proc Natl Acad Sci USA 1995; 92 : 10673–7. 19. Khan SA, Ndjountche L, Pratchard L, et al. Follicle-stimulating hormone amplifies insulin-like growth factor I-mediated activation of AKT/protein kinase B signaling in immature rat Sertoli cells. Endocrinology 2002; 143 : 2259–67. 20. Meroni SB, Riera MF, Pellizzari EH, et al. FSH activates phosphatidylinositol 3-kinase/protein kinase B signaling pathway in 20-day-old Sertoli cells independently of IGF-I. J Endocrinol 2004; 180 : 257–65. 21. Zhou J, Kumar TR, Matzuk MM, et al. Insulin-like growth factor I regulates gonadotropin responsiveness in the murine ovary. Mol Endocrinol 1997; 11 : 1924–33. 22. Monget P, Fabre S, Mulsant P, et al. Regulation of ovarian folliculogenesis by IGF and BMP system in domestic animals. Domest Anim Endocrinol 2002; 23 : 139–54. 23. Park Y, Maizels ET, Feiger ZJ, et al. Induction of cyclin D2 in rat granulosa cells requires FSH-dependent relief from FOXO1 repression coupled with positive signals from Smad. J Biol Chem 2005; 280 : 9135–48. 24. Richards JS, Sharma SC, Falender AE, et al. Expression of FKHR, FKHRL1, and AFX genes in the rodent ovary : evidence for regulation by IGF-I, estrogen, and the gonadotropins. Mol Endocrinol 2002; 16 : 580–99. 25. Nechamen CA, Thomas RM, Cohen BD, et al. Human follicle-stimulating hormone (FSH) receptor interacts with the adaptor protein APPL1 in HEK 293 cells : potential involvement of the PI3K pathway in FSH signaling. Biol Reprod 2004; 71 : 629–36. 26. Jiang M, Aittomaki K, Nilsson C, et al. The frequency of an inactivating point mutation (566C->T) of the human follicle-stimulating hormone receptor gene in four populations using allele-specific hybridization and time-resolved fluorometry. J Clin Endocrinol Metab 1998; 83 : 4338–43. 27. Rannikko A, Parakinen P, Manna PR, et al. Functional characterization of the human FSH receptor with an inactivating Ala189Val mutation. Mol Hum Reprod 2002; 8 : 311–7. 28. Kumar TR, Wang Y, Lu N et al. Follicle stimulating hormone is required for ovarian follicle maturation but not male fertility. Nat Genet 1997; 15 : 201–14. |